
移动阅读
随着经济全球化时代的到来,我国对能源的需求量显著增加,“以煤为主”的能源消费结构在短时间内很难改变[1-2]。SO2是煤炭燃烧过程中释放的主要污染物之一,会导致酸雨等问题,对生态环境和人类健康带来严重影响[3-4]。石灰石-石膏法是目前最成熟的脱硫技术,但该方法的耗水量大、设备复杂、运行成本高,难以应用在干旱缺水的地区[5]。因此,开展干法脱硫技术的研究具有重要意义。
活性炭由于丰富的孔隙结构和表面官能团,具有吸附能力强、化学稳定性好、可再生回收等优点,被广泛应用于干法烟气脱硫技术[6-7]。我们课题组之前针对活性炭物理化学性质对脱硫的影响开展了系统的研究工作[5,8-10],这些工作对于活性炭的制备优化起到了一定的指导作用。在活性炭的制备原料中,煤炭在我国储量丰富,且含碳量高、价格低廉。以煤为原料制备高品质活性炭具有良好的应用前景,国内外也对此进行了一系列的研究[11-12]。AKASH等发现煤在炭化过程中的内部结构变化主要是由挥发分热解造成的[13]。GONG等以无烟煤为原料制备活性炭,结果表明活化温度对孔隙结构的影响最显著,其次是活化时间和活化剂用量[14]。YAN等在800 ℃下采用ZnCl2活化煤热解产物,得到的活性炭吸附SO2效果较好[15]。
目前针对煤基活性炭的制备参数优化,主要采用单变量或正交法进行设计,缺少系统、准确的实验数据。同时,针对SO2吸附的活性炭结构及表面定向调控,还有待进一步研究。基于上述问题,笔者以神华煤为原料,采用ZnCl2活化法制备活性炭,基于响应曲面法系统探究了炭化温度、炭化时间、升温速率对活性炭孔隙结构的影响;同时通过NaOH表面处理,显著提升了SO2吸附容量,实现煤基活性炭脱硫的定向调控。
本次实验的活性炭制备原料采用神华煤,对煤样的预处理步骤如下:用去离子水完全浸没煤样,85 ℃恒温水浴搅拌2 h,过滤并充分洗涤后,在110 ℃恒温干燥24 h,取粒度小于0.5 mm备用。煤样的工业分析和元素分析结果见表1。
表1 原料煤的工业分析与元素分析
Table 1 Proximate analysis and ultimate analysis of raw coal %
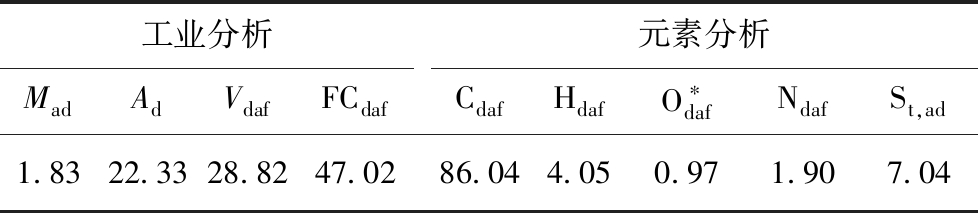
工业分析MadAdVdafFCdaf元素分析CdafHdafO∗dafNdafSt,ad1.8322.3328.8247.0286.044.050.971.907.04
注:* 表示差值法。
本实验采用响应曲面法(RSM)优化煤基活性炭的制备参数,确定对活性炭孔结构具有显著影响的3个影响因子:炭化温度、升温速率和炭化时间,制备条件设计方案见表2。
表2 实验设计方案
Table 2 Experimental design matrix

编号炭化温度/℃升温速率/(℃·min-1)炭化时间/h1700512700102370015348005258001036800151790053890010199001521080010211800531270010313800511490052157005216700101179001031870015219800153
具体实验步骤如下:称取21 g氯化锌配成250 mL溶液,加入5 g预处理后的神华煤样品,85 ℃恒温水浴搅拌3 h。加热结束后将烧杯中的混合物过滤,取滤渣放入管式炉。在100 mL/min氮气保护下,以5~15 ℃/min速率升温至700~900 ℃,炭化1~3 h。炭化产物用0.5 mol/L的稀盐酸洗涤,再用去离子水洗涤、过滤至滤液呈中性。洗涤后的产物放入恒温干燥箱,110 ℃下干燥24 h。根据表2中的制备工况编号,活性炭标记为AC-n(n=1,2,3,…,19)。
采用碱处理对煤基活性炭进行表面改性。称取5 g煤基活性炭分别加入100 mL质量分数10%,20%和30%的NaOH溶液,65 ℃恒温水浴加热0.5 h,随后在室温中静置0.5 h。反复用去离子水洗涤、过滤至滤液呈中性。洗涤后的产物放入恒温干燥箱,110 ℃下干燥24 h。改性后的活性炭根据制备工况编号和NaOH浓度,标记为AC-n-Na10,AC-n-Na20和AC-n-Na30。
采用美国Micrometrics ASAP2020全自动物理/化学吸附分析仪在77 K下通过静态N2吸附法测定。根据BET 方法计算总比表面积,相对压力p/p0=0.99时的氮吸附量计算总孔容,t-plot法计算微孔比表面积和微孔孔容,密度函数理论(DFT)计算得到孔径分布。
采用荷兰SIRION 型场发射扫描电子显微镜(SEM)观察活性炭的微观形貌结构。将样品放在铜台上,在最大加速电压10 kV,点分辨率1.5 nm条件下采集得到图像信息。
采用美国Thermo Nicolet Nexus 670 型傅里叶变换红外光谱仪对活性炭的表面官能团进行分析。将样品与KBr 粉末按1∶100比例混合研磨后,通过压片机压片。在分辨率为 4 cm-1的条件下,收集范围为4 000~400 cm-1的红外光谱谱线。
采用Boehm滴定的方法测量活性炭表面的酸/碱性官能团。称取1 g样品放入锥形瓶中,分别加入25 mL的0.1 mol/L的盐酸、氢氧化钠、碳酸氢钠、碳酸钠。将锥形瓶恒温振荡1 h后过滤,用0.1 mol/L的NaOH或HCl进行滴定,根据消耗量计算活性炭表面官能团的数量。
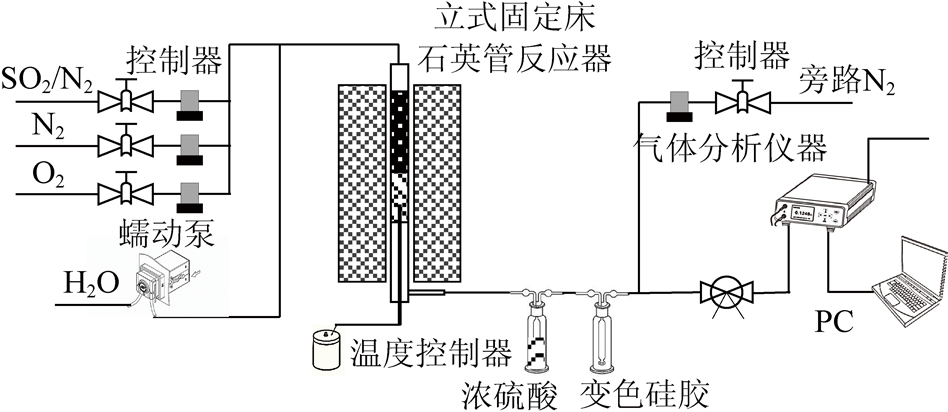
图1 吸附实验系统
Fig.1 Schematic diagram of adsorption experimental system
附实验在固定床反应器中进行,实验系统如图1所示。反应器采用内径10 mm的石英管,模拟烟气由400×10-6 SO2,10% O2,10% H2O和高纯N2配成。气体流量均由质量流量计精确控制,H2O由蠕动泵控制,在混气段进行预热气化,保证进入固定床反应器的H2O以水蒸气形式存在。气体混合均匀后进入反应器,在120 ℃温度下进行SO2吸附,出口气体通入Testo 350烟气分析仪进行在线测量。实验前活性炭置于110 ℃恒温箱干燥24 h,去除活性炭中的水分。每次实验称取样品300 mg,反应器空速为30 000 h-1。通过穿透曲线计算SO2的吸附容量:
(1)
式中,q为吸附容量,mg/g;Q0为气体总流量,mL/min;m为活性炭质量,g;t0为SO2出口浓度达到稳定状态(即吸附饱和)的时间;c0和c(t)分别为SO2的初始浓度和出口浓度。
根据响应曲面法设计的19种不同工况制备活性炭的孔结构参数见表3。
选择炭化温度、升温速率和炭化时间作为自变量,采用RSM模型拟合不同制备参数下的活性炭比表面积,得到多项回归方程:
表3 活性炭孔隙结构参数和SO2吸附量
Table 3 Pore structure characteristics and SO2 adsorption capacity of activated carbon
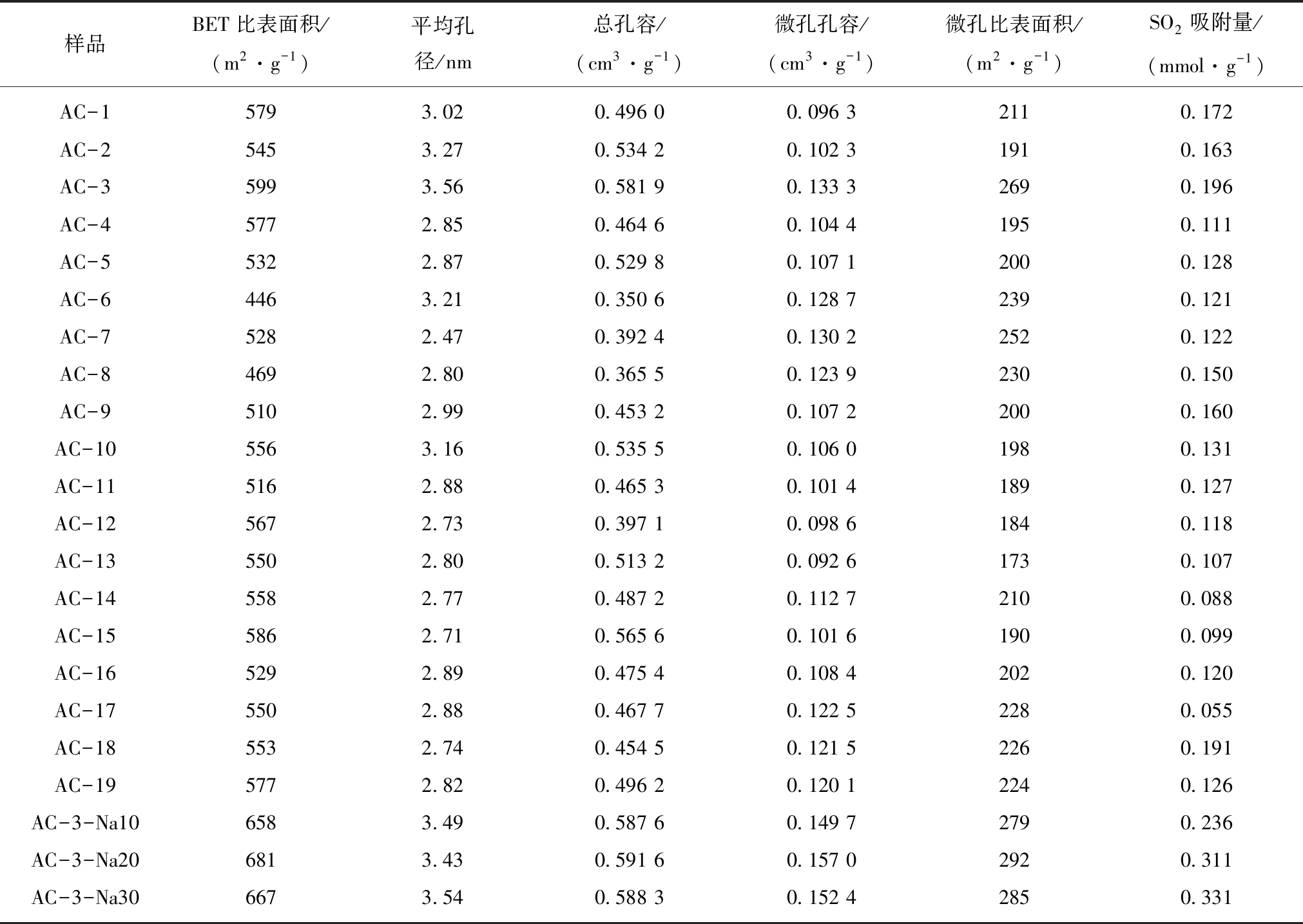
样品BET比表面积/(m2·g-1)平均孔径/nm总孔容/(cm3·g-1)微孔孔容/(cm3·g-1)微孔比表面积/(m2·g-1)SO2吸附量/(mmol·g-1)AC-15793.020.496 00.096 32110.172AC-25453.270.534 20.102 31910.163AC-35993.560.581 90.133 32690.196AC-45772.850.464 60.104 41950.111AC-55322.870.529 80.107 12000.128AC-64463.210.350 60.128 72390.121AC-75282.470.392 40.130 22520.122AC-84692.800.365 50.123 92300.150AC-95102.990.453 20.107 22000.160AC-105563.160.535 50.106 01980.131AC-115162.880.465 30.101 41890.127AC-125672.730.397 10.098 61840.118AC-135502.800.513 20.092 61730.107AC-145582.770.487 20.112 72100.088AC-155862.710.565 60.101 61900.099AC-165292.890.475 40.108 42020.120AC-175502.880.467 70.122 52280.055AC-185532.740.454 50.121 52260.191AC-195772.820.496 20.120 12240.126AC-3-Na106583.490.587 60.149 72790.236AC-3-Na206813.430.591 60.157 02920.311AC-3-Na306673.540.588 30.152 42850.331
S=967-0.48A-22B-54C-0.003 5
AB+0.13AC+8.4BC+0.000 06A2+
0.22B2-27C2
(2)
式中,S为煤基活性炭比表面积,m2/g;A为炭化温度,℃;B为升温速率,℃/min;C为炭化时间,h。
表4是回归方程的方差分析结果,其中P值和F值都是判断影响因素准确性和重要性的指标。当P值>0.1时,说明影响因素对于模型的重要性较低,当P值<0.05时,说明影响因素对于模型的重要性较高[16]。
去除回归方程中的不显著项后,得到比表面积的精简预测模型方程:
S=939-0.42A-21B-52C+
0.13AC+8.5BC-28C2
(3)
为了进一步验证模型的准确性,活性炭比表面积的预测值与实验值对比如图2所示。可以看出,实验值基本分布在拟合直线附近,说明选用的模型可以较为准确地预测实验结果。图3是炭化温度和升温速率、炭化温度和炭化时间、升温速率和炭化时间的响应曲面图。在各影响因素的取值范围内,随着炭化时间的增加,比表面积增大;随着炭化温度的升高,比表面积减小;随着升温速率的提高,比表面积增大。综合3种影响因素判断,最佳比表面积制备条件为炭化温度为700 ℃,升温速率为15 ℃/min,炭化时间为3 h。
表4 回归方程方差分析
Table 4 Analysis of variance for the regression equation
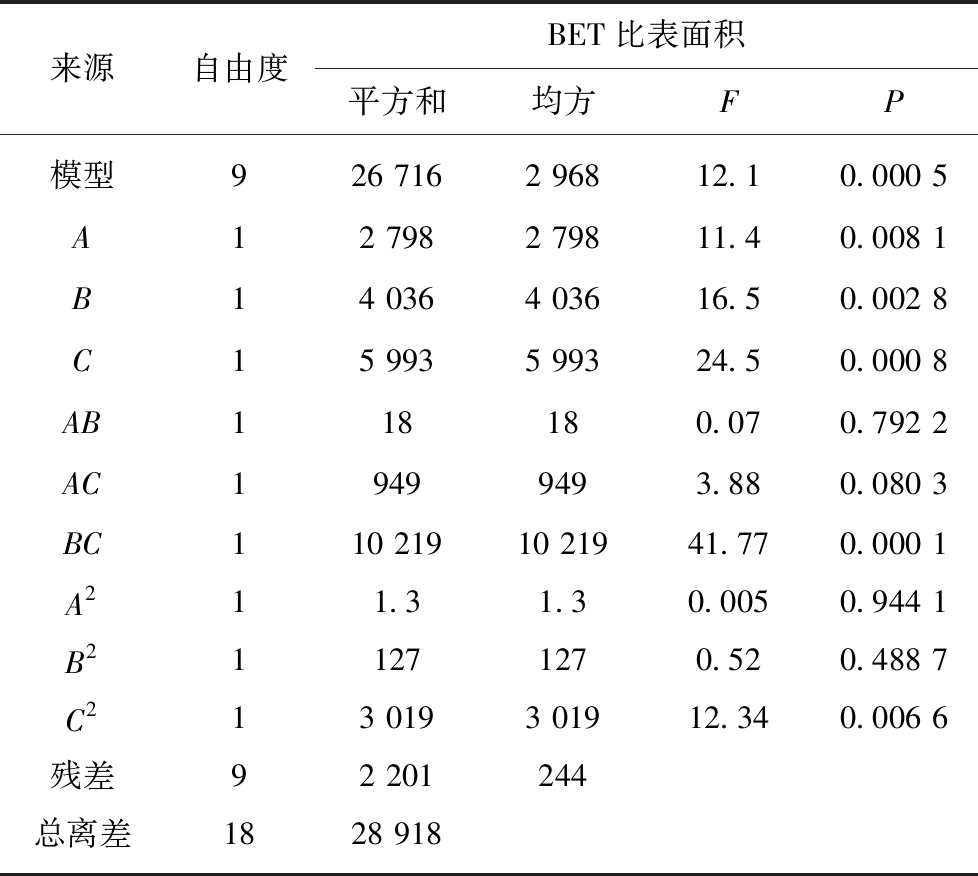
来源自由度BET比表面积平方和均方FP模型926 7162 96812.10.000 5A12 7982 79811.40.008 1B14 0364 03616.50.002 8C15 9935 99324.50.000 8AB118180.070.792 2AC19499493.880.080 3BC110 21910 21941.770.000 1A211.31.30.0050.944 1B211271270.520.488 7C213 0193 01912.340.006 6残差92 201244总离差1828 918
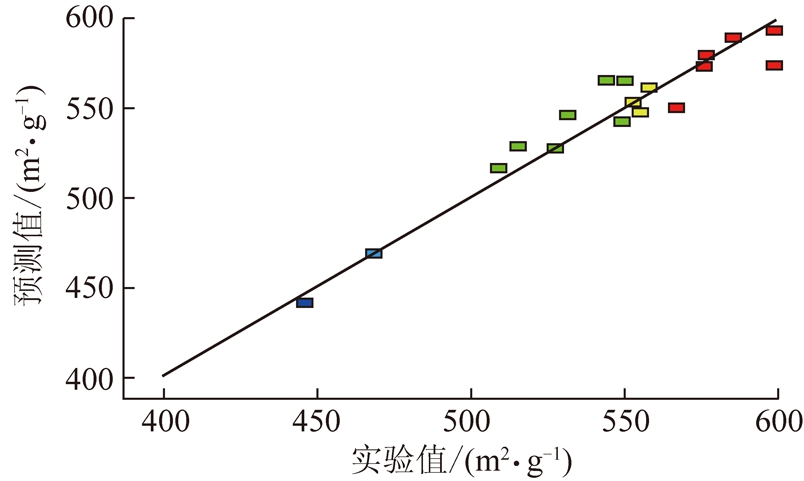
图2 活性炭比表面积的预测值与实验值比较
Fig.2 Predicted values and experimental BET surface area values of activated carbon

图3 比表面积响应面立体图
Fig.3 Three-dimensional response surface plot of specific surface area
根据响应曲面优化结果,确定煤基活性炭的制备工况为炭化温度700 ℃、升温速率15 ℃/min、炭化时间3 h,对此工况得到的AC-3进行NaOH表面改性。采用扫描电镜观察神华煤、活性炭及3个改性后样品的表面微观结构,如图4所示。原料煤的表面比较光滑,而经过炭化和活化后的样品则出现了丰富的孔隙结构。NaOH改性后,活性炭的表面更加凹凸不平,出现了大量的附着碳颗粒。随着NaOH浓度的提高,活性炭孔结构被破坏的更剧烈,可能是因为NaOH溶液清除了孔隙内的部分杂质,并与碳骨架发生氧化还原反应。
图5是改性活性炭的氮气吸附-脱附等温线及孔径分布,对应的孔结构参数见表3。可以看出,活性炭均属于Ⅰ型吸附等温线,具有发达的微孔结构。且随着NaOH浓度的增加,达到饱和时的吸附量有着明显的区别,说明不同NaOH浓度处理活性炭的孔结构存在差异。所有样品在p/p0=0.5左右出现脱附滞后现象,表明活性炭的中孔占有一定的比例。由DFT孔径分布可知,活性炭的孔隙主要分布在0.5~0.6,0.7~0.9和1.0~4.0 nm。随着NaOH浓度的增加,比表面积和孔容呈先增大后减小的趋势,在20%浓度时活性炭具有最高的比表面积(681 m2/g)和最大的孔容(0.591 6 cm3/g)。说明低浓度的碱处理对活性炭有扩孔的效果,而碱浓度过高会导致孔结构破坏,比表面积和孔容下降,与扫描电镜的结果一致。
通过红外光谱对改性活性炭的表面官能团进行定性分析,如图6所示。所有活性炭在3 428 cm-1附近出现了明显的吸收峰,是由表面吸附水的羟基伸缩振动引起的[17]。位于1 258 cm-1的吸收峰可能是由于C—O的伸缩振动引起,而1 583 cm-1处的吸收峰对应于C![]() C的伸缩振动[18]。当NaOH浓度增加到30%时,在1 446 cm-1左右出现明显的C
C的伸缩振动[18]。当NaOH浓度增加到30%时,在1 446 cm-1左右出现明显的C![]() O吸收峰,说明高浓度碱处理在活性炭表面引入了大量羰基[19]。
O吸收峰,说明高浓度碱处理在活性炭表面引入了大量羰基[19]。
进一步采用Boehm滴定法对活性炭表面的含氧官能团进行定量分析。从表5中可以看出,未改性的AC-3样品表面羧基、羟基的含量分别为0.321 mmol/g和0.347 mmol/g,碱性基团含量0.274 mmol/g。NaOH改性会导表面羧基、羟基等酸性基团的含量下降,而碱性基团则出现明显的增幅。30%NaOH处理样品的羰基含量(0.293 mmol/g)明显高于其余样品,且碱性基团含量最高(0.557 mmol/g),与图6的红外光谱结果一致。

图4 原料煤及改性活性炭SEM照片
Fig.4 SEM images of Shenhua coal,AC-3,AC-3-Na10,AC-3-Na20 and AC-3-Na30

图5 改性活性炭氮气吸-脱附等温线及孔径分布
Fig.5 N2 adsorption-desorption isotherms and pore size distributions of modified activated carbon
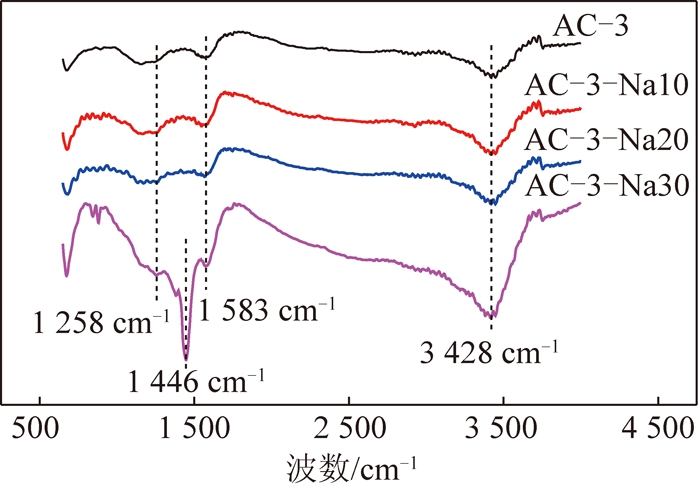
图6 改性活性炭的红外光谱
Fig.6 FTIR spectra of modified activated carbon
表5 改性活性炭表面官能团的含量
Table 5 Amount of surface functional groups on modified activated carbon
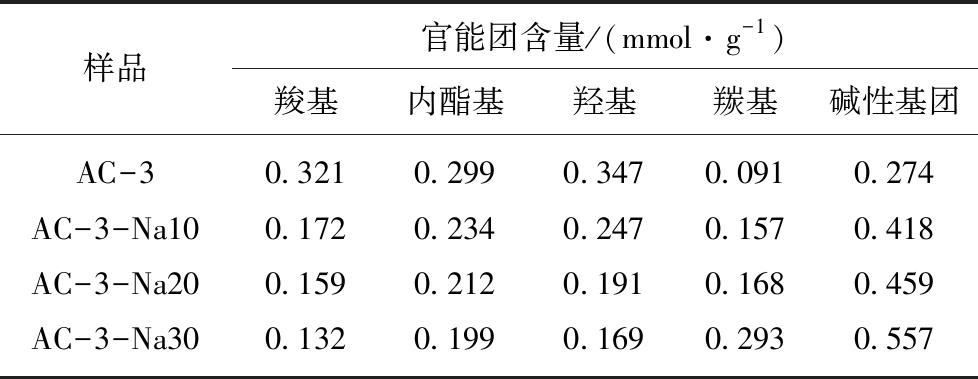
样品官能团含量/(mmol·g-1)羧基内酯基羟基羰基碱性基团AC-30.3210.2990.3470.0910.274AC-3-Na100.1720.2340.2470.1570.418AC-3-Na200.1590.2120.1910.1680.459AC-3-Na300.1320.1990.1690.2930.557
对改性活性炭进行SO2吸附实验研究,根据穿透曲线计算得到样品的SO2吸附量,列在表3中。可以看出,未改性活性炭AC-3的吸附量为0.196 mmol/g。随着NaOH浓度的增加,SO2吸附量显著增加,30%NaOH处理后吸附量达到0.331 mmol/g。可能是由于NaOH处理后,一方面增加了活性炭的比表面积,尤其是微孔比表面积,有利于SO2分子在碳基吸附剂表面的吸附;另一方面在活性炭表面引入了羰基等碱性位点,而SO2是酸性分子,通过与碱性位点之间发生电子转移而强化了SO2在活性炭表面的吸附[20]。
进一步对活性炭的微孔比表面积、碱性基团含量与SO2吸附量的相关性进行分析,如图7所示。结果表明SO2吸附量与微孔比表面积和碱性官能团含量呈正线性相关,且碱性官能团含量的相关性高于微孔比表面积。从上述实验结果可以推断,NaOH改性增加了活性炭的微孔比表面积,强化了SO2分子的吸附,并在表面碱性位点的作用下使SO2转化为稳定态的物质,提高了活性炭对SO2的吸附能力[15]。
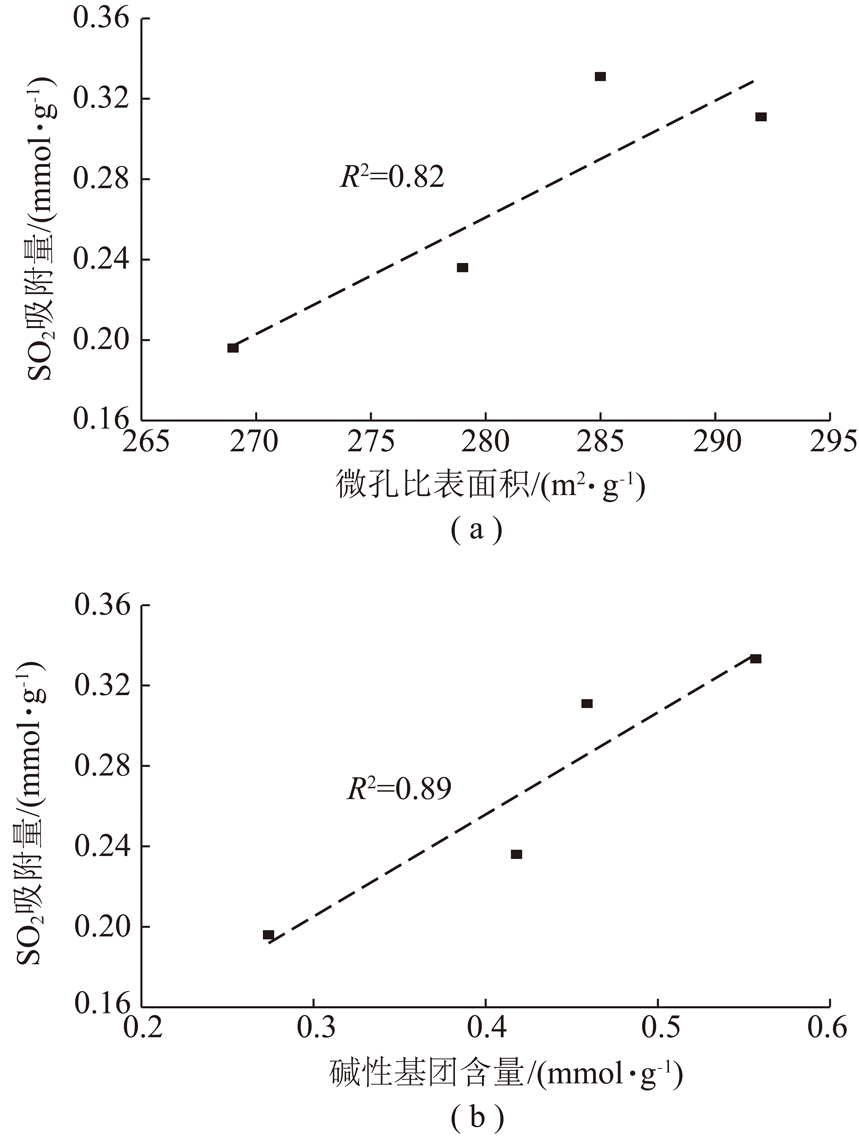
图7 活性炭结构及表面特性与SO2吸附量的相关性
Fig.7 Correlation between properties of activated carbon and SO2 adsorption capacity
(1)基于响应曲面法,对煤基活性炭的制备参数进行了详细的探究,建立了炭化温度、升温速率和炭化时间对活性炭比表面积的预测模型,并得到了比表面积最大的制备条件:炭化温度700 ℃,升温速率15 ℃/min,炭化时间3 h。
(2)采用NaOH对煤基活性炭进行表面改性,发现随着碱浓度的增加,活性炭表面的碱性基团含量增加,30%NaOH处理后表面碱性基团含量最高为0.557 mmol/g;活性炭的比表面积和孔容则呈先增大后减小趋势,20% NaOH处理后比表面积和孔容最大为681 m2/g和0.591 6 cm3/g。
(3)通过SO2吸附测试发现,煤基活性炭的吸附容量与表面碱性基团含量和微孔比表面积呈正线性相关,且碱性官能团含量的相关性高于微孔比表面积,说明表面碱性基团和微孔结构有利于SO2在活性炭表面的吸附。
[1] 刘欣.碳材料表面化学结构对SO2吸附及氧化影响的量子化学研究[D].哈尔滨:哈尔滨工业大学,2016:1-2.
LIU Xin.The effect of surface structure of carbon materials surface on SO2 adsorption and oxidation:A DFT calculation study[D].Harbin:Harbin Institute of Technology,2016:1-2.
[2] 马双忱,马京香,金鑫,等.微波辐照活性炭床同时脱除SO2和NOx实验研究[J].工程热物理学报,2013,34(1):26-30.
MA Shuangchen,MA Jingxiang,JIN Xin,et al.Experimental study on simultaneous removal of SO2 and NOx using activated carbon under microwave irradiation[J].Journal of Engineering Thermophysics,2013,34(1):26-30.
[3] GUNKA Volodymyr,PYSHYEV Serhiy.Lignite oxidative desulphurization.Notice 1:Process condition selection[J].International Journal of Coal Science & Techonology,2014,1(1):62-69.
[4] TAO Xiuxiang,XU Ning,XIE Maohua,et al.Progress of the technique of coal microwave desulfurization[J].International Journal of Coal Science & Techonology,2014,1(1):113-128.
[5] 刘少俊,曹飞飞,高翔.金属氧化物对SO2在活性炭表面吸附影响的实验研究[J].动力工程学报,2013,33(9):476-480.
LIU Shaojun,CAO Feifei,GAO Xiang.Effect of metallic oxides on adsorption of SO2 on activated carbon[J].Journal of Chinese Society of Power Engineering,2013,33(9):476-480.
[6] DIANA Lopez,ROBISON Buitrago,ANTONIO Sepulvedaescribano,et al.Low temperature catalytic adsorption of SO2 on activated carbon[J].Journal of Physical Chemistry C,2016,112(39):15335-15340.
[7] 王海鸿,刘应书,李子宜,等.活性炭脱除SO2吸附动力学模型及数值模拟[J].煤炭学报,2015,40(1):203-211.
WANG Haihong,LIU Yingshu,LI Ziyi,et al.Kinetic models and numerical simulation of SO2 adsorption on activated carbon[J].Journal of China Coal Society,2015,40(1):203-211.
[8] 刘少俊,高翔,曹飞飞,等.孔隙结构对活性炭脱硫影响的实验研究[J].中国电机工程学报,2012,32(35):46-52.
LIU Shaojun,GAO Xiang,CAO Feifei,et al.Effect of pore structure on SO2 removal by activated carbons[J].Proceedings of the CSEE,2012,32(35):46-52.
[9] 刘少俊,高翔,曹飞飞.化学性质对活性炭脱硫的影响[J].煤炭学报,2013,38(7):1242-1247.
LIU Shaojun,GAO Xiang,CAO Feifei.Effect of chemical properties on SO2 removal by activated carbons[J].Journal of China Coal Society,2013,38(7):1242-1247.
[10] GAO Xiang,LIU Shaojun,ZHANG Yang,et al.Physicochemical pro-perties of metal-doped activated carbons and relationship with their performance in the removal of SO2 and NO[J].Journal of Hazardous Materials,2011,188(1):58-66.
[11] 邢宝林,黄光许,谌伦建,等.高品质低阶煤基活性炭的制备与表征[J].煤炭学报,2013,38(1):217-222.
XING Baolin,HUANG Guangxu,SHEN Lunjian,et al.Preparation and characterization of high quality low-rank coal based activated carbon[J].Journal of China Coal Society,2013,38(1):217-222.
[12] GUNKA Volodymyr,PYSHYEV Serhiy.Lignite oxidative desulphurization.Notice 2:Effects of process parameters[J].International Journal of Coal Science & Techonology,2014,1(1):62-69.
[13] BILAL Akash,WILLIAM O’Brien.The production of activated carbon from a bituminous coal[J].International Journal of Energy Research,2015,20(10):913-922.
[14] GONG Guozhuo,LIU Ji,YANG Wenfen,et al.Preparation of coal-based columnar activated carbon for removal of benzene[J].Materials Science Forum,2017,878:101-107.
[15] YAN Zheng,LIU Lili,ZHANG Yueling,et al.Activated semi-coke in SO2 removal from fuel gas:Selection of activation methodology and desulfurization mechanism study[J].Energy & Fuels,2013,27(6):3080-3089.
[16] 程松,张利波,夏洪应,等.响应曲面法优化CO2活化制备夏威夷坚果壳基活性炭[J].环境工程学报,2015,9(9):4495-4502.
CHENG Song,ZHANG Libo,XIA Hongying,et al.Preparation of activated carbon from Hawaii nut shell via CO2 activation using response surface methodology[J].Chinese Journal of Environmental Engineering,2015,9(9):4495-4502.
[17] 黄丽,孙康,朱光真,等.活性炭微结构及其对丁酮吸附-脱附性能的影响[J].林产化学与工业,2017,37(5):146-152.
HUANG Li,SUN Kang,ZHU Guangzhen,et al.Effect of adsorption and desorption of butanone on micropore structure of activated carbon[J].Chemistry and Industry of Forest Products,2017,37(5):146-152.
[18] 杨晓霞,郑小峰,郭延红,等.ZnCl2活化红枣核制备多微孔活性炭及表征[J].功能材料,2015,46:124-131.
YANG Xiaoxia,ZHENG Xiaofeng,GUO Yanhong,et al.Preparation and characterization of activated carbon from red jujube kernel activated by ZnCl2[J].Functional Materials,2015,46:124-131.
[19] 丁春生,沈嘉辰,缪佳,等.改性活性炭吸附饮用水中三硝基甲烷的研究[J].中国环境科学,2013,33(5):821-826.
DING Chunsheng,SHEN Jiachen,MIU Jia,et al.Adsorption of trichloronitromethane in drinking water by modified activated carbon[J].China Environmental Science,2013,33(5):821-826.
[20] 李先春,熊祖宁,董珍,等.生物质和褐煤共气化半焦吸附烟气SO2的研究[J].煤炭转化,2016,39(4):31-36.
LI Xianchun,XIONG Zuning,DONG Zhen,et al.Adsorption characteristics of SO2 using co-gasification of biomass and lignite char[J].Coal Conversion,2016,39(4):31-36.