黏土矿物是煤泥水中微细颗粒的主要组成部分,对煤泥水的沉降澄清及脱水有着显著的不利影响。大量研究表明黏土矿物表面的水化以及表面荷电直接影响黏土矿物微细颗粒在溶液中的分散行为[1-2]。NOSRATI等[3]研究了白云母微细颗粒之间的作用力对其分散特性的影响规律。DUMANA等[4-5]研究了不同类型离子对溶液中高岭石颗粒的分散性的影响。SALLES等[6]测定了蒙脱石颗粒的润湿热并计算了颗粒间静电斥力,分析了蒙脱石在溶液中的膨胀机理。FERRAGE[7]采用XRD分析了蒙脱石层间水化膜的结构特性。MARRY等[8]通过分子动力学模拟研究了不同黏土矿物颗粒层间荷电特性和水化膜结构。
由于亲水性矿物颗粒表面对水分子具有很强的吸引作用,水分子在不同亲水特性矿物颗粒表面形成一定厚度的水化膜[9]。矿物颗粒表面水化膜中水的结构不同与正常水,其具有黏度大、密度高的特点。溶液中水化矿物颗粒相互接近致一定距离时会产生水化斥力和空间位阻效应,使矿物颗粒难以聚团沉降[10]。PENG等[11]通过原子力显微镜发现了水溶液中SiO2表面存在水化膜的实验证据。国内外学者在矿物及材料表面水化方面开展了大量的研究。LEBODA等[12]采用核磁共振测定了TiO2表面形成的水化膜厚度;ALEKSEYEV等[13]采用电渗法研究了不同粒度石英颗粒表面水化特性及颗粒间的作用力;DAMIR等[14]利用透射电镜和纳米压痕法测定了玻璃表面水化膜厚度。SONG等[15-17]提出了黏度法间接测定颗粒表面水化膜的具体方法并测量了SiO2表面的水化度。近年来,随计算机技术的进步,量子化学及分子动力学模拟计算得到较快发展,为矿物颗粒表面水化理论模拟计算研究提供了强有力的支持[18]。
本文针对煤泥颗粒表面水化是煤泥水难以沉降脱水的主要原因,以煤泥水中主要黏土矿物高岭石和蒙脱石为研究对象,采用分子动力学模拟研究了高岭石及蒙脱石颗粒表面水化分子动力学特性,模拟计算了颗粒的界面水平衡构型、界面原子浓度、水分子扩散系数及金属离子的影响,以期为煤泥水的有效沉降澄清及脱水提供理论依据。
1 模型构建和计算方法
1.1 模型构建
模型的构建和计算采用美国Accelrys公司开发的Material studios(MS)8.0 软件进行。
高岭石和蒙脱石初始计算模型的构建采用密度泛函理论方法[19-20]进行几何优化后的单胞结构。其中高岭石的晶胞参数为:a=5.20×10-10 m,b=9.01×10-10 m,c=7.37×10-10 m,α=93.03°,β=106.00°,γ=89.87°,其中,a,b,c为晶胞轴长;α,β,γ为晶胞轴角(图1)。蒙脱石初始构型以叶腊石八面体层中的 Al3+被 Mg2+取代,然后采用碱金属阳离子Na+来中和平衡由于晶格取代所产生的负电荷,从而构建出蒙脱石的初始晶体计算模型[21](图2),密度泛函理论方法几何优化后的蒙脱石晶胞模型参数为:a=5.19×10-10 m,b=9.01×10-10 m,c=9.50×10-10 m,α=91.02°,β=101.79°,γ=89.84°;其化学式为Na0.5Al3.5Mg0.5Si8O20(OH)4,其中每个单胞中含0.5 e的负电荷。
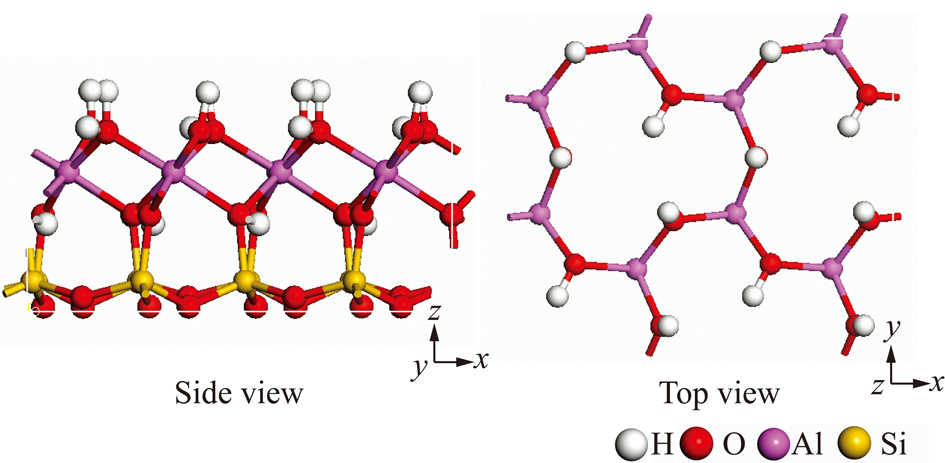
图1 高岭石(001)层面的表面结构
Fig.1 Surface structure of kaolinite (001) basal surface
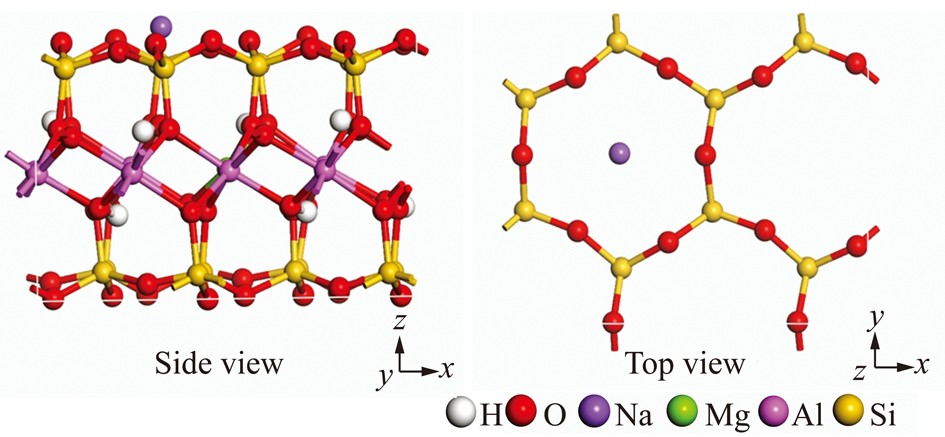
图2 蒙脱石(001)层面的表面结构
Fig.2 Surface structure of montmorillonite (001) basal surface
研究以高岭石和蒙脱石颗粒(001)面为主要对象。首先,将高岭石和蒙脱石单晶胞结构放大为(4×2×1)的超晶胞,通过切割形成(001)面,并在(001)面上加8 nm的真空层,用于防止高岭石和蒙脱石相邻两层面间的相互影响。BOEK等[22]采用蒙特卡洛(又称统计模拟法)模拟研究表明,当64个水分子进入含有8个单晶胞的蒙脱石结构中时,能够足以形成双层水化膜,同时导致蒙脱石结构膨胀4.9×10-10 m,该研究结论与实际实验结果相吻合。根据此研究结论及相关文献结论,本文对高岭石和蒙脱石(4×2×1)超晶胞模型,在模拟计算过程中以32个水分子作为一个单元,采用MS软件中的Amorphous Cell模块构建出分别含有32,64,96和128个水分子的水分子层。根据高岭石和蒙脱石的结构可以知道,其(4×2×1)超晶胞模型中表面分别含有48个Os原子,如果定义单层覆盖率(φ,Monolayer)为界面水分子数等于高岭石和蒙脱石表面Os原子数,则含有32,64,96和128个水分子的水分别相当于2φ/3,4φ/3,6φ/3和8φ/3。运用MS软件的Build Layer工具将不同数量的水分子分别添加到高岭石和蒙脱石超晶胞表面上,从而构建出高岭石-水及蒙脱石-水的界面结构。
1.2 模拟计算方法
分子动力学(Molecular Dynamics,MD)模拟计算采用 MS 8.0 软件中的 Forcite plus 模块进行。计算力场采用专门适用于黏土矿物体系ClayFF力场,该力场采用分子间静电作用和范德华力作用来模拟计算黏土矿物颗粒表面原子间的成键作用[23]。SPC 模型用于水分子计算[24],采用 NVT系综,计算系统温度控制采用 Nose 方法,计算时间步长为 0.7 fs。为减少分子间不合理的接触,首先采用共轭梯度法对模型体系进行几何优化,在体系平衡 300 ps后,对体系能量和温度随时间变化的收敛曲线进行监测,以确保体系达到平衡状态。在体系完全平衡后,再继续200 ps的结果输出计算,数据采集间隔为 100 fs。分子间的长程静电作用及范德华作用的加和计算分别采用 Ewald法和Atom based 方法。由于对非键作用的截断半径要小于高岭石和蒙脱石晶胞参数的一半,所以模拟计算中截断半径采用 0.9 nm。
2 结果及分析
2.1 界面水的空间平衡结构
图3为不同水覆盖率下高岭石(001)面上水分子的吸附平衡构型。计算结果表明,距离高岭石(001)面最近的一层水分子主要以Os…Hw氢键及Hs…Ow氢键的形式与表面发生相互作用,与此同时水分子间通过氢键作用形成空间网络结构。
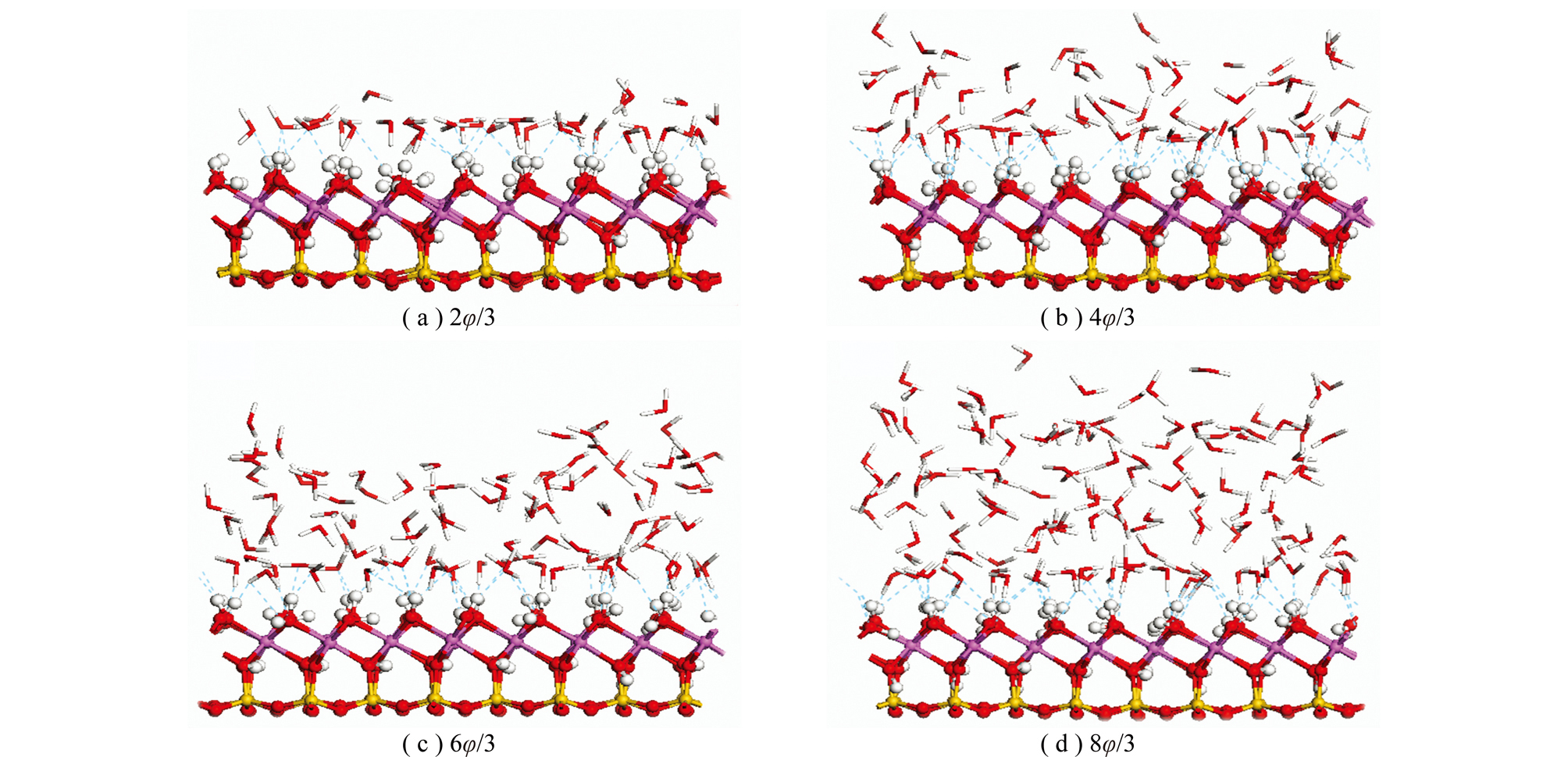
图3 水分子在高岭石(001)面吸附的空间平衡结构 Fig.3 Spatial equilibrium structures of water adsorbed on kaolinite (001) surface
图4为不同水分子覆盖率下蒙脱石(001)面上水分子的平衡构型。在初始模型结构中Na+位于蒙脱石(001)表面,在分子热运动和蒙脱石(001)面水化作用的驱动下Na+逐渐离开表面向溶液环境中扩散。当水覆盖率为2φ/3时,Na+一方面和蒙脱石(001)表面Os形成配位,同时与水分子Ow发生配位,形成内球形配位结构;而当水分子覆盖率增大到4φ/3时,Na+不再和蒙脱石(001)面Os发生直接作用,而是与水分子Ow发生配位作用,此时,形成外球形配位结构。同时,可以发现最靠近蒙脱石(001)表面的一层水分子以“Γ型”方式并通过氢键作用吸附,水分子间通过氢键形成网络结构,即界面水分子与蒙脱石(001)表面存在Os…Hw的表面-水氢键作用及水分子间Ow…Hw的水-水氢键作用。
2.2 界面处原子浓度分布
图5为不同水分子覆盖率下高岭石(001)面及蒙脱石(001)面法线方向Ow原子浓度分布曲线。由图5(a)所示,当水分子覆盖率为2φ/3时,高岭石(001)面法线方向Ow原子浓度分布曲线只出现一个浓度峰,其位置在距离高岭石(001)面1.52×10-10 m处;当水分子覆盖率增加到4φ/3时,在距离高岭石(001)面4.05×10-10 m处水分子Ow原子浓度分布曲线出现第2个峰;当水分子覆盖率增至8φ/3时,在距离高岭石(001)面8.12×10-10 m处水分子Ow原子浓度分布曲线呈现第3个峰;与此同时,随水分子覆盖率的不断增大,水分子Ow原子浓度分布曲线中各峰的高度降低,且向z正方向发生一定的偏移。图5(b)表明,蒙脱石(001)面法线方向在距离表面0~15×10-10 m界面处出现多个浓度峰位。当2φ/3水分子覆盖率下,水分子Ow原子浓度仅出现一个位于表面2.63×10-10 m处的峰。当水分子覆盖率增大到4φ/3时,第1个水分子Ow原子浓度峰的位置外移到2.93×10-10 m处,同时出现位于表面5.6×10-10 m处第2个水分子Ow浓度峰;当水分子覆盖率增大到8φ/3时,在9.6×10-10 m处甚至出现第3个水分子Ow浓度峰,形成第3个水层。
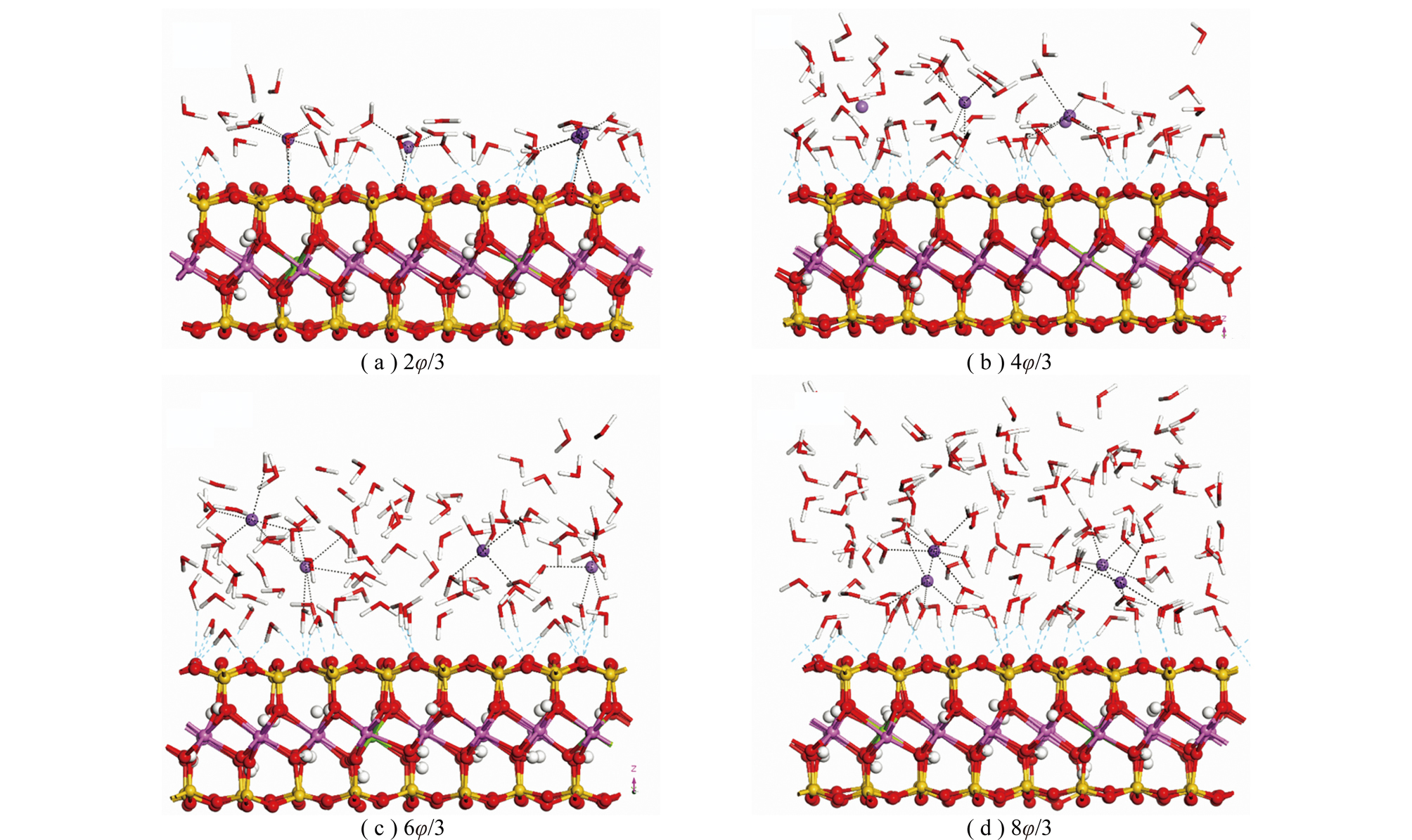
图4 水分子在蒙脱石表面上空间平衡结构
Fig.4 Spatial equilibrium structures of water on montmorillonite surface
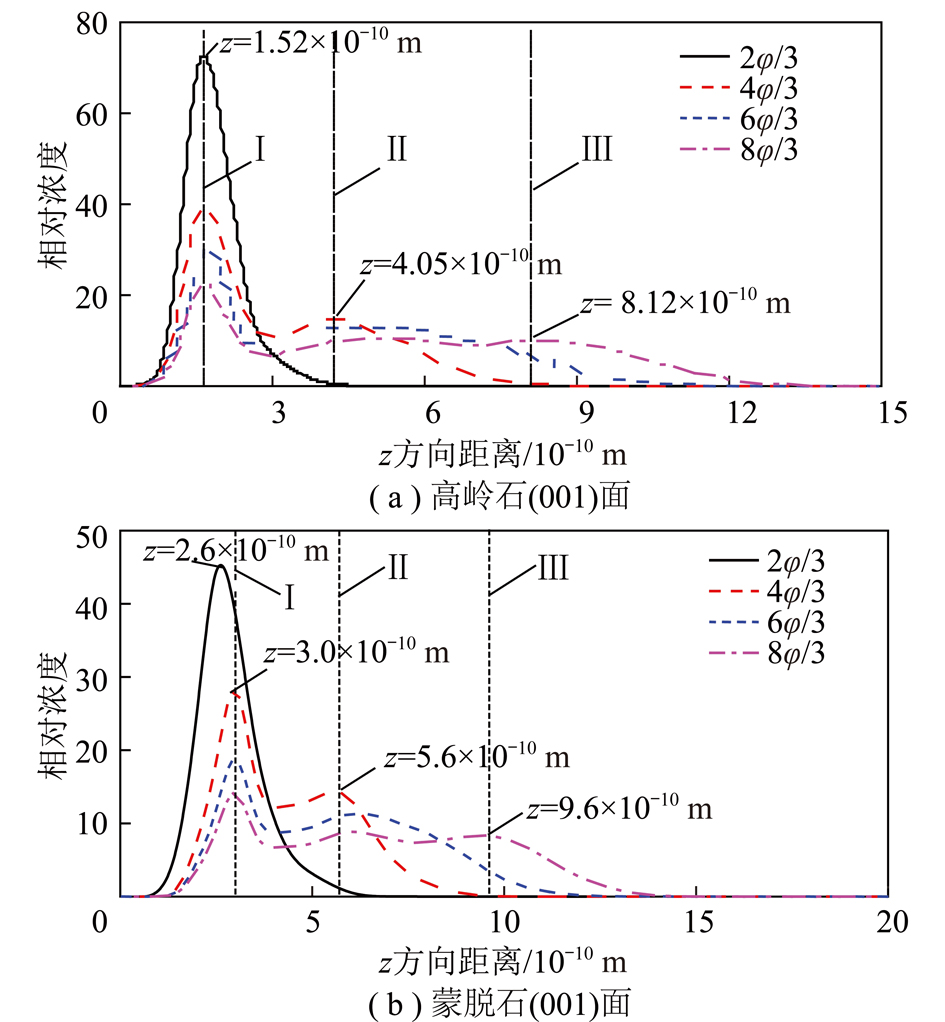
图5 高岭石(001)面及蒙脱石(001)面法线方向Ow原子浓度分布曲线
Fig.5 Concentration profile of Ow in the normal direction of kaolinite (001) surface and montmorillonite (001) surface
计算结果表明,当水分子覆盖率较小的情况下,水分子在高岭石和蒙脱石(001)表面结合紧密,随水分子覆盖率的不断增大,高岭石和蒙脱石(001)面对水分子的束缚能力逐渐减弱,水分子在高岭石和蒙脱石(001)表面逐渐形成多个水分子层(图5中Ⅰ,Ⅱ,Ⅲ);不同水分子覆盖率下Ow原子浓度分布曲线中第1个浓度峰为靠近高岭石和蒙脱石(001)表面的水分子与表面形成氢键的结果,随水覆盖率的增大,氢键作用逐渐减弱。ARGYRIS等[25]研究了氧化铝表面Al终端和—OH终端的界面水结构和动力学行为,与本研究得出相似结果,水分子层在氧化铝表面一直延续到距离表面约10×10-10 m处,再远处接近体相水的性质。
2.3 界面处原子间径向分布函数
(1)水-水原子间径向分布函数
矿物颗粒界面水分子Ow—Ow原子间的径向分布函数的峰宽和峰高可以分别反映水分子间的相对位置和有序度的强弱;水分子Ow—Hw原子间的径向分布函数的第1个峰的峰宽和峰高分别反映水分子Ow—Hw原子间形成氢键的长度和有序度强弱。因此,通过分析矿物颗粒界面水分子Ow—Ow与Ow—Hw原子间的径向分布函数可以了解物颗粒表面吸附水分子结构特点。
图6,7分别为高岭石和蒙脱石(001)面水分子Ow—Ow和Ow—Hw原子间的径向分布函数。由图6,7可知,水分子Ow—Ow和Ow—Hw原子间的径向分布函数峰的位置基本没有变化,说明界面水和体相水的结构基本相似;而随高岭石和蒙脱石(001)面水分子数的不断增大,水分子原子间的径向分布函数峰的强度不断减小,表明水分子间的排列有序度不断减小,这是因为高岭石和蒙脱石(001)表面水分子数增大,形成多个水分子层,使界面效应减弱,高岭石和蒙脱石(001)表面对远离表面的水分子有序度的影响减小,反过来,越靠近高岭石和蒙脱石(001)面的水分子其有序度越高,便会形成有序的界面水结构。
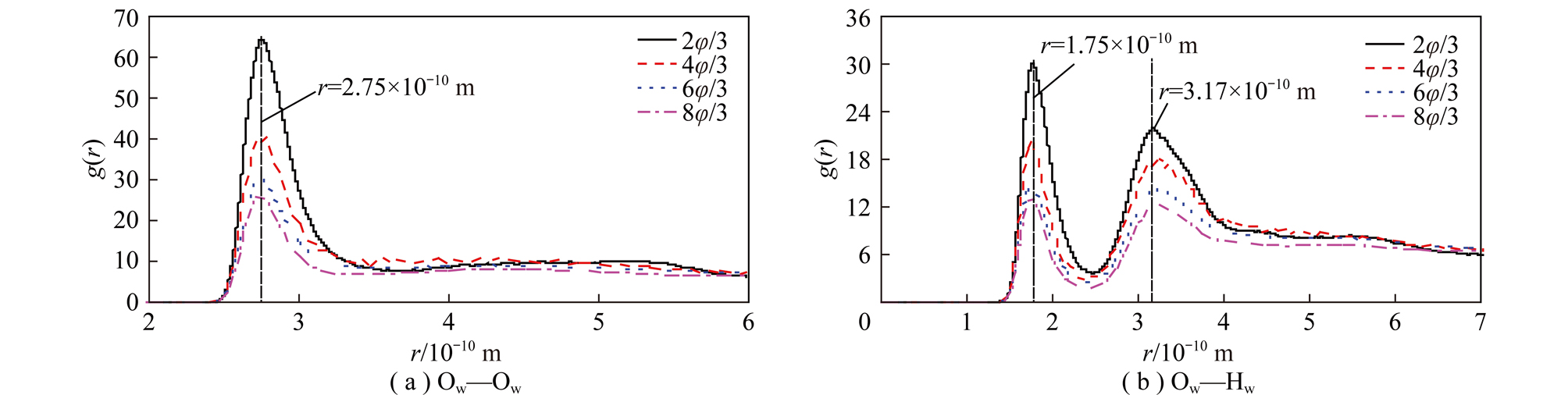
图6 高岭石(001)面Ow—Ow与Ow—Hw原子间的径向分布函数
Fig.6 Atomic radial distribution function between Ow—Ow and Ow—Hw of kaolinite (001) surface
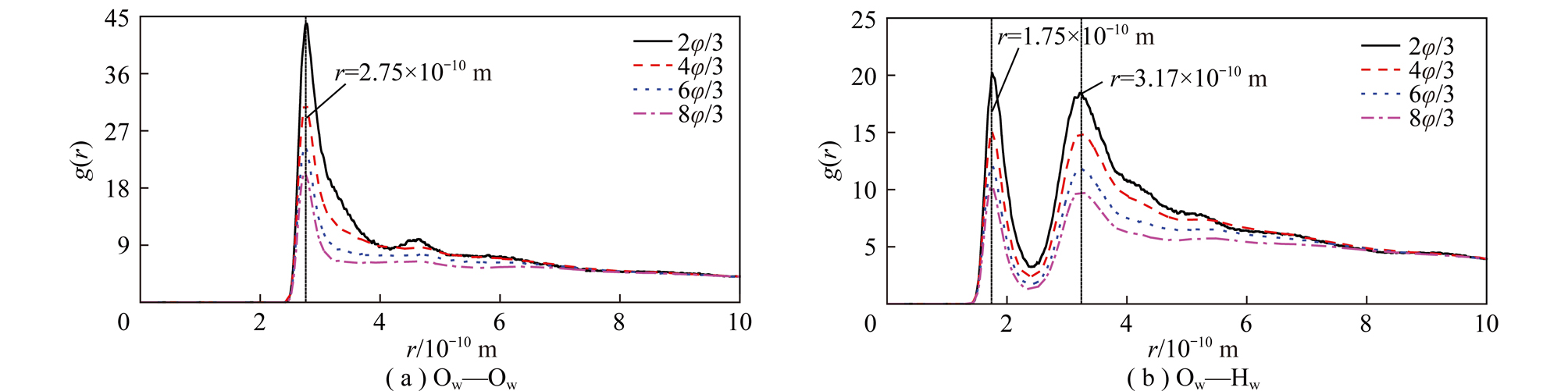
图7 蒙脱石(001)面Ow—Ow与Ow—Hw原子间的径向分布函数
Fig.7 Atomic radial distribution function between Ow—Ow and Ow—Hw of montmorillonite (001) surface
(2)表面-水原子间径向分布函数
图8为高岭石(001)面Os—Hw以及Hs—Ow原子间的径向分布函数。由图8可知,高岭石(001)面Os—Hw与Hs—Ow原子间径向分布函数的峰形虽不同,但随水分子覆盖率增大,峰的位置相对变化不大,而峰的强度都不断减小。这说明随水分子数的增加,水分子在高岭石(001)面排列的有序度不断减弱。这是因为水分子数的增加导致高岭石(001)表面水分子层数变多,使得表面对水分子的束缚力减小。
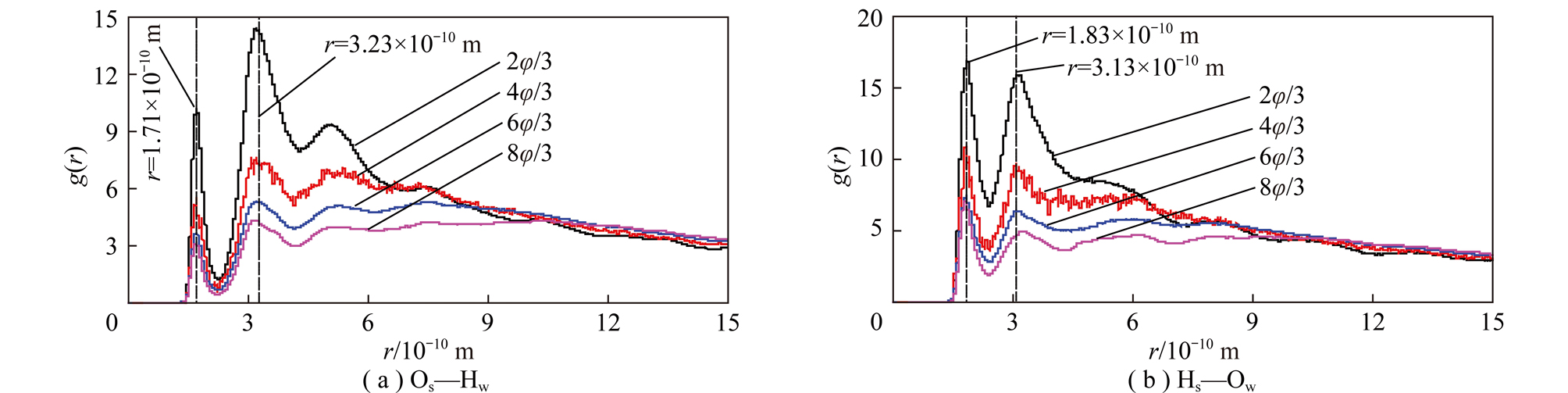
图8 高岭石(001)面Os—Hw与Hs—Ow原子间的径向分布函数
Fig.8 Atomic radial distribution function between Os—Hw and Hs—Ow of kaolinite (001) surface
图9为蒙脱石(001)面Os—Hw原子间的径向分布函数。在蒙脱石(001)r=1.9×10-10 m和2.3×10-10 m处Os—Hw原子间的径向分布函数分别出现第1和第2峰。第1峰对应着蒙脱石(001)面Os原子和水分子Hw原子间的氢键。由图9可知,随水分子数的增大峰的强度减弱,表明蒙脱石(001)界面处水分子的有序性和氢键减弱。当蒙脱石(001)面水分子覆盖率从6φ/3增大到8φ/3时,峰减弱的程度较小,说明界面水的结构趋于稳定。
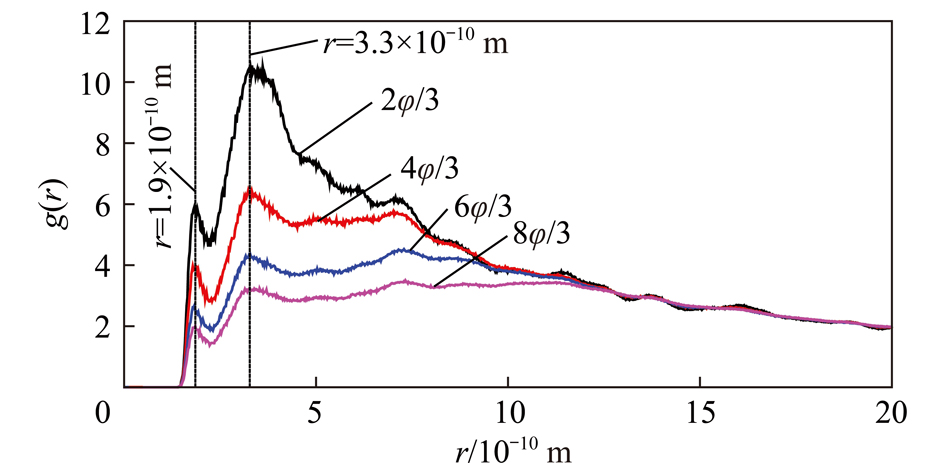
图9 蒙脱石(001)面Os—Hw原子间的径向分布函数
Fig.9 Atomic radial distribution function between Os—
Hw of montmorillonite (001) surface
2.4 金属阳离子对界面水结构的影响
煤泥水中存在不同的阳离子,阳离子对煤泥水的沉降会产生影响,阳离子的存在同时会影响煤泥颗粒表面水化特性。图10为蒙脱石(001)表面水分子覆盖率为8φ/3时Na+,K+,Ca2+和Mg2+离子沿蒙脱石(001)表面法线方向的浓度分布曲线。由图10可知,Na+,K+,Ca2+和Mg2+最高峰分别位于距离蒙脱石(001)面2.1×10-10,4.1×10-10,4.4×10-10和5.7×10-10 m处。其中K+的最高峰距离蒙脱石(001)面最近,说明部分K+在蒙脱石(001)表面形成了内球型配位结构,在这种结构中K+和蒙脱石(001)表面之间没有水分子存在,K+和蒙脱石(001)表面的6个氧原子直接配位;另外一部分K+形成外球型配位结构,位于距离蒙脱石(001)表面较远的地方,如图11(b)所示。Na+,Ca2+和Mg2+离子均形成外球型配位结构,如图11(a),(c)和(d)所示。
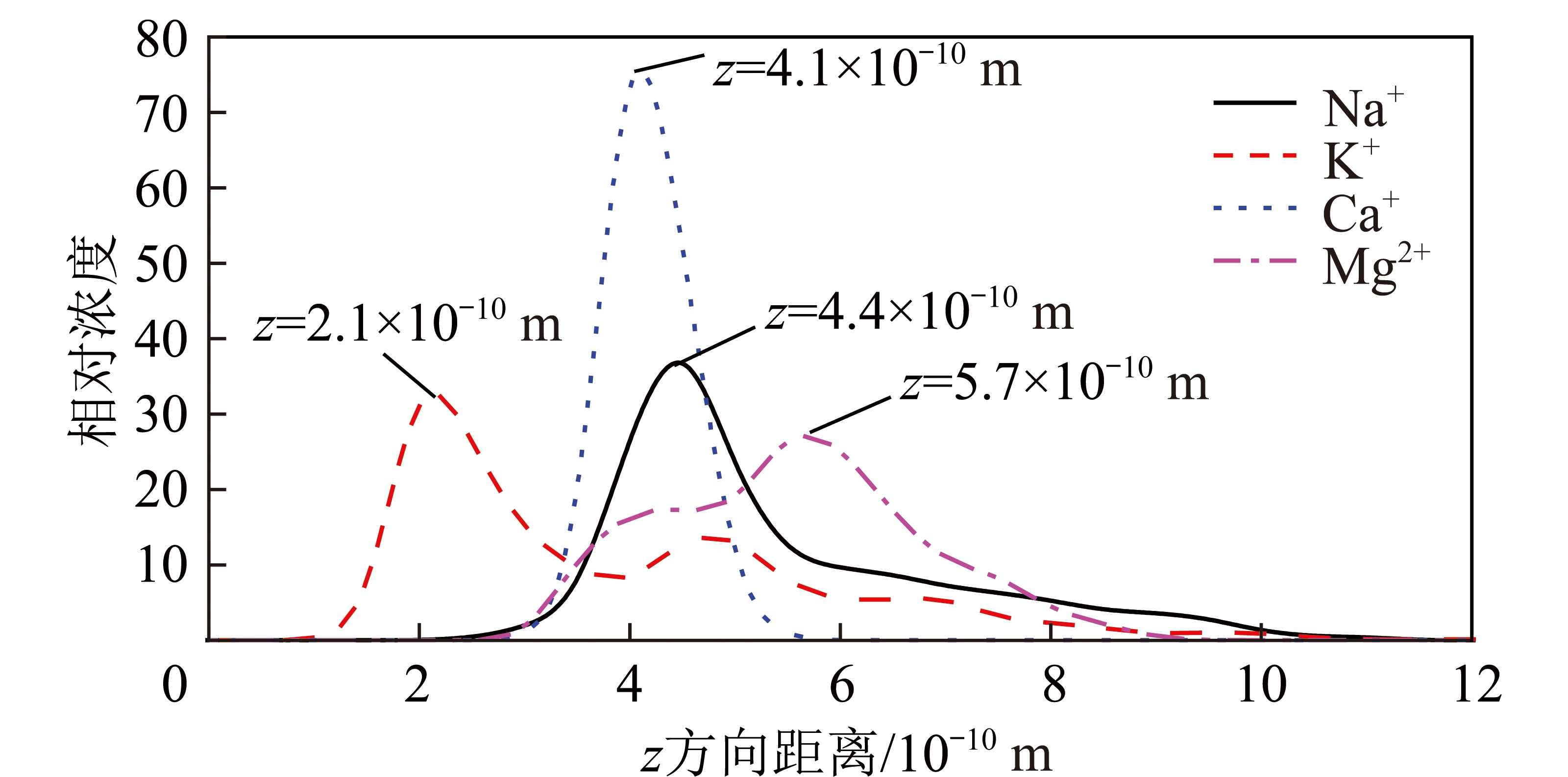
图10 金属阳离子沿蒙脱石(001)表面法线方向的相对浓度分布曲线(8φ/3 H2O覆盖率)
Fig.10 Concentration profile of metal cations in the normal direction of montmorillonite (001) surface under the water coverage fraction of 8φ/3
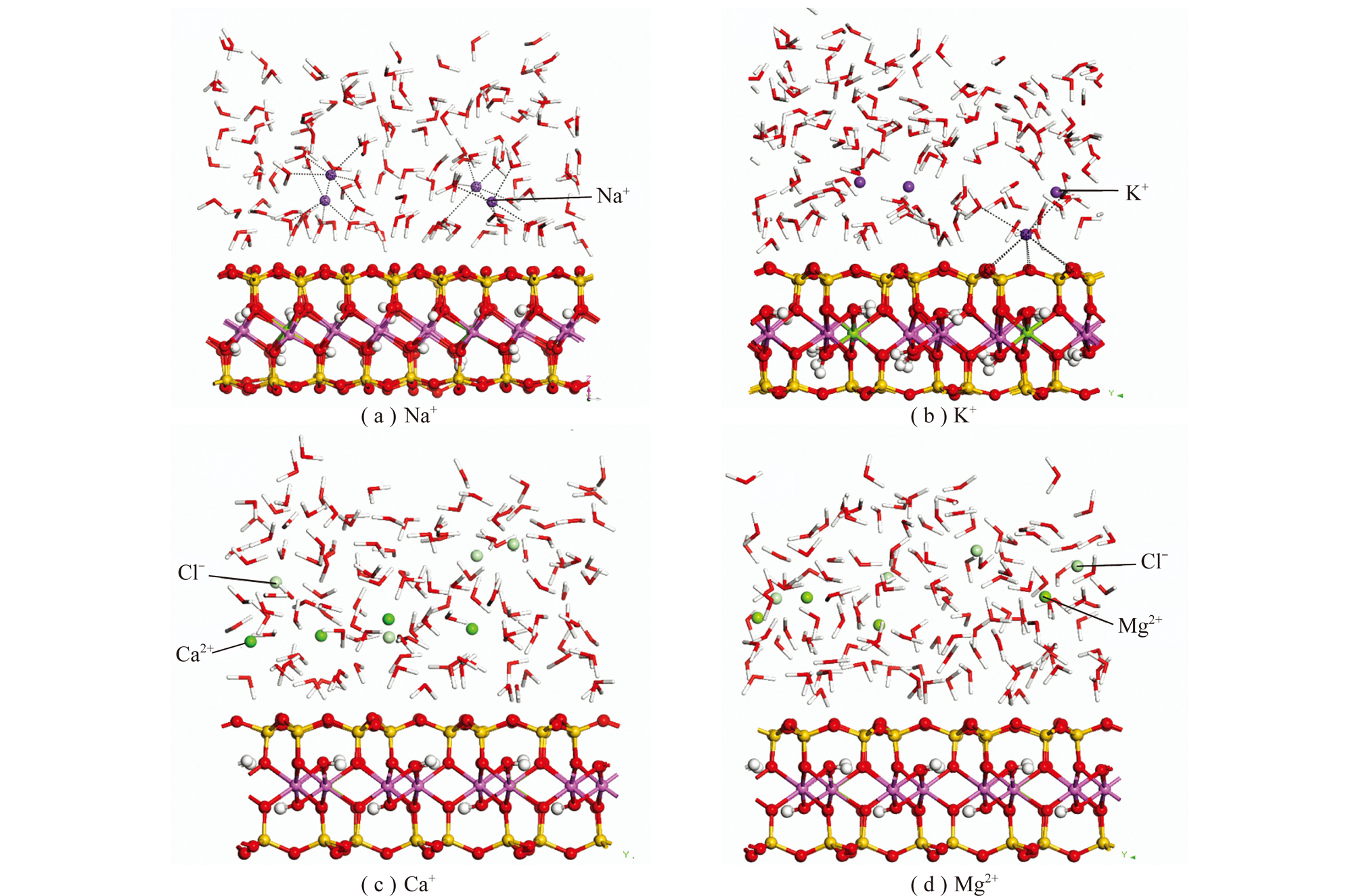
图11 金属阳离子在蒙脱石界面处的空间平衡构型(8φ/3 H2O覆盖率)
Fig.11 Equilibrium configuration of metal cations at the interface of montmorillonite under the water coverage fraction of 8φ/3
图12为Na+,K+,Ca2+和Mg2+相同浓度条件下水分子Ow原子沿蒙脱石(001)表面法线方向的浓度分布曲线。由图12可知,在不同阳离子作用下水分子Ow原子的浓度分布曲线有区别,但都形成3层水分子结构,水化层的厚度约为9.6×10-10 m。不同金属阳离子对蒙脱石(001)界面水化层结构特征的影响较小。
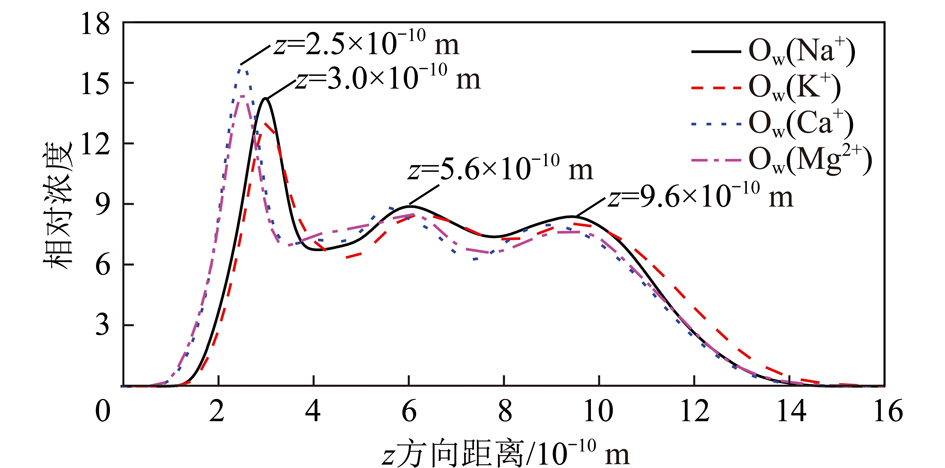
图12 不同金属阳离子环境下水分子Ow原子沿蒙脱石(001)
表面法线方向的浓度分布曲线(8φ/3 H2O覆盖率)
Fig.12 Concentration profile of Ow atoms in the normal direction of montmorillonite (001) surface in the aqueous solutions containing different types of metal caitons under the water coverage fraction of 8φ/3
图13为不同金属阳离子和水分子Ow原子间径向分布函数。由图13可以发现,Mg2+—Ow,Na+—Ow,Ca2+—Ow和K+—Ow间径向分布函数第1峰分别位于r=2.0×10-10 m,r=2.4×10-10 m,r=2.5×10-10 m和r=2.8×10-10 m处,即离子水化壳中水分子距离Mg2+最近,然后依次是Na+,Ca2+和K+,其中,原子间径向分布函数第1峰的高度大小顺序为:Mg2+>Ca2+>Na+>K+,即离子和水分子间的有序度依次降低。第1径向分布函数峰位和高度反映出蒙脱石(001)界面处Mg2+的水化程度最大,对蒙脱石(001)界面水化膜的影响最大,其次是Ca2+和Na+,最后是K+。
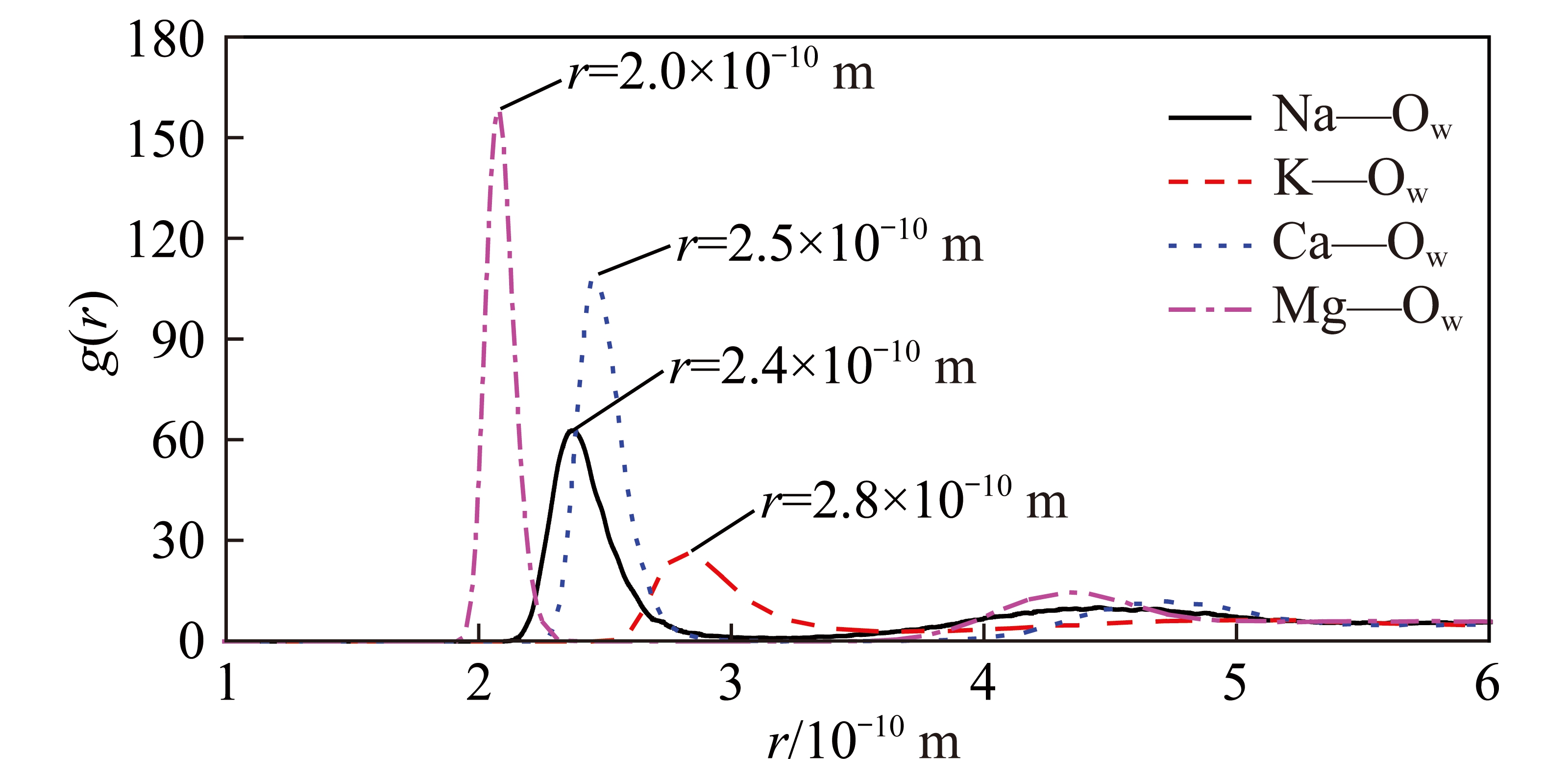
图13 离子和Ow原子间径向分布函数(8φ/3 H2O覆盖率)
Fig.13 Radial distribution function between caions and Ow atoms (Na—Ow,K—Ow,Ca—Ow,and Mg—Ow) under the water coverage fraction of 8φ/3
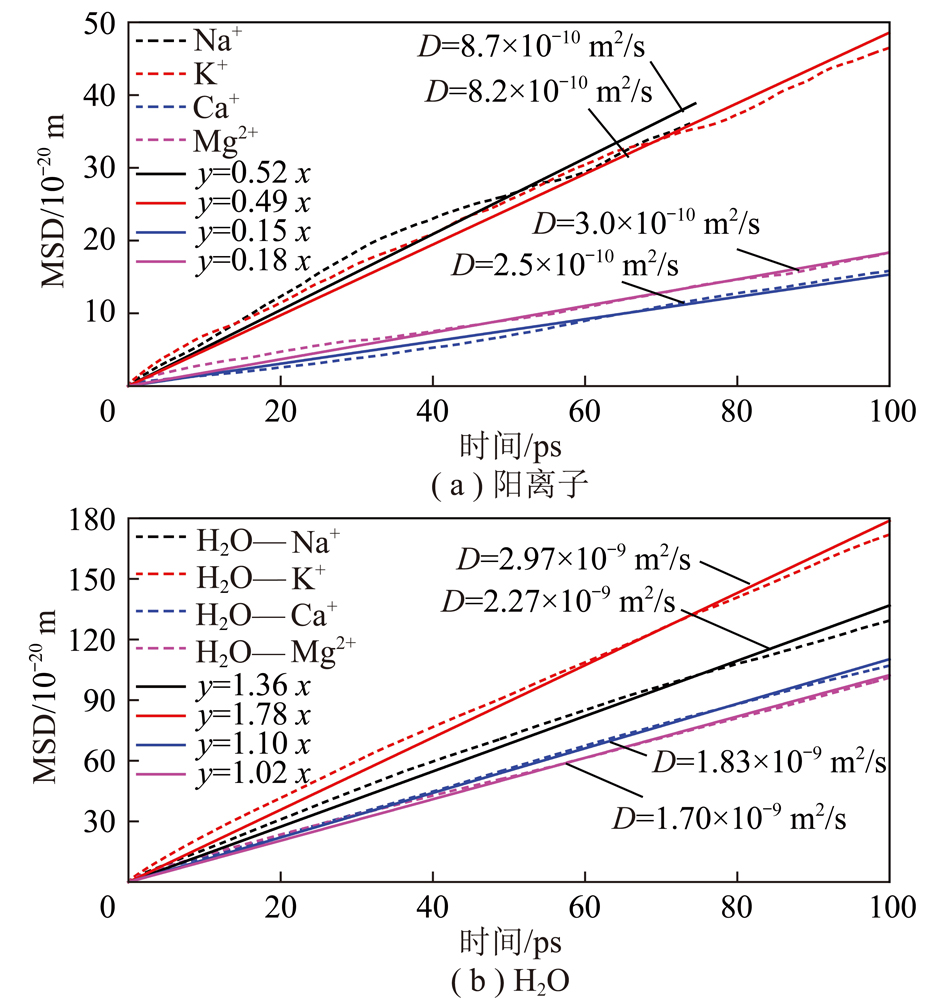
图14 不同金属阳离子环境下阳离子和H2O的均方根位移及线性拟合
Fig.14 Mean squared displacement and linear fitting of metal cations and H2O molecules in the aqueous solutions containing different types of metal caitons
图14(a)为不同金属阳离子的均方根位移及线性拟合。由图14可知,Ca2+和Mg2+的扩散系数分别为2.5×10-10和3.0×10-10 m2/s;Na+和K+的扩散系数分别为8.7×10-10和8.2×10-10 m2/s。二价阳离子Ca2+和Mg2+的扩散系数明显小于一价阳离子Na+和K+,仅为其1/2,其原因是二价的金属阳离子受到蒙脱石(001)面的静电引力比一价阳离子大,不容易扩散。
图14(b)为不同金属阳离子溶液环境下水分子的均方根位移及线性拟合。由图14可知,水分子的扩散系数比阳离子扩散系数大一个数量级,不同金属阳离子对水分子的扩散系数的影响不同。在Mg2+,Ca2+,Na+和K+存在的情况下,水分子的扩散系数分别为1.7×10-9,1.83×10-9,2.27×10-9和2.97×10-9 m2/s。水分子扩散系数越小说明移动性越差,受到金属阳离子束缚程度越强,金属离子的水化作用越强,不同金属离子水化作用能力强弱顺序为:Mg2+ >Ca2+ >Na+ >K+。这一结果和前面离子和Ow原子间的径向分布函数结果相一致。
3 结 论
(1)界面处水分子主要以Os…Hw氢键和Hs…Ow氢键吸附在高岭石(001)面,以Os…Hw氢键吸附在蒙脱石(001)面,同时水分子间通过氢键作用形成空间网络结构。
(2)随水分子在矿物颗粒表面覆盖率的增大,矿物颗粒表面对水分子的束缚力逐渐减小,界面处氢键作用逐渐减弱,水分子在亲水性的高岭石和蒙脱石(001)面逐渐形成3个水分子层(总厚度为(8~10)×10-10 m);高岭石(001)面水化程度大于蒙脱石(001)面。
(3)二价金属离子对蒙脱石水化的促进作用强于一价金属离子,不同金属阳离子对蒙脱石界面水化作用能力的强弱顺序为:Mg2+ >Ca2+>Na+ >K+。
参考文献(References):
[1] PEFFERKORN E.Clay and oxide destabilization induced by mixed alum/macromolecular flocculation aids[J].Advances in Colloid and Interface Science,2006,120:33-45.
[2] LAGALY G,ZIESMER S.Colloid chemistry of clay minerals:the coagulation of montmorillonite dispersions[J].Advances in Colloid and Interface Science,2003,100:105-128.
[3] NOSRATI A,ADDAI-MENSAH J,SKINNERK W.Muscovite clay mineral particle interactions in aqueous media[J].Powder Technology,2012,219:228-238.
[4] DUMANA O,TUNC S,CETINKAYA A.Electrokinetic and rheological properties of kaolinite in poly (diallyldimethylammonium chloride),poly(sodium 4-styrene sulfonate) and poly(vinyl alcohol) solutions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2012,394:23-32.
[5] RAO F,RAMIREZ-ACOSTA F J,SANCHEZ-LEIJA R J,et al.Stability of kaolinite dispersions in the presence of sodium and aluminum ions[J].Applied Clay Science,2011,51(1-2):38-42.
[6] SALLES F,BILDSTEIN O,DOUILLARD J M,et al.Determination of the driving force for the hydration of the swelling clays from computation of the hydration energy of the interlayer cations and the clay layer[J].J Phys Chem C,2007,111:13170-13176.
[7] FERRAGE E.Investigation of smectite hydration properties by modeling experimental X-ray diffraction patterns:Part I.Montmorillonite hydration properties[J].American Mineralogist,2005,90(8-9):1358-1374.
[8] MARRY V,TURQ P.Microscopic simulations of interlayer structure and dynamics in bihydrated heteroionic montmorillonites[J].The Journal of Physical Chemistry B,2003,107:1832-1839.
[9] DERJAGUIN B V,CHURAEV N V,MULLER V M.Surface forces[M].New York:Consultants Bureau,1987:15-96.
[10] PASHLEY R M.Hydration forces between mica surfaces in aqueous electrolyte solutions[J].Journal of Colloid and Interface Science,1981,80(1):153-162.
[11] PENG C,SONG S,FORT T.Study of hydration layers near a hydrophilic surface in water through AFM imaging[J].Surface and Interface Analysis,2006,38(8):975-980.
[12] LEBODA R,TUROV V V,MARCINIAK M,et al.Characteristics of the hydration layer structure in porous titania-silica obtained by the chemical vapor deposition method[J].Langmuir,1999,15:8441-8446.
[13] ALEKSEYEV O L,BOJKO Y P,PAVLOVA L A.Electroosmosis in concentrated colloids and the structure of the double electric[J].Colloid and Surfaces A:Physicochem Eng Aspects,2003,222:27-34.
[14] DAMIR R T,RUSSELL J H,PENG Z.Comparison of glass hydration layer thickness measured by transmission electron microscopy and nanoindentation[J].Material Letters,2010,60:1041-1044.
[15] PENG C,SONG S,LU S.Determination of solvation film thickness of dispersed particles with the method of einstein viscosity equation[J].Journal of University of Science and Technology Beijing,2005,12(4):370-375.
[16] PENG C,SONG S.Determination of thickness of hydration layers on mica in aqueous solutions by using AFM[J].Surface Review and Letters,2004,11(6):485-489.
[17] SONG S,PENG C,OLIVARES M A G.Study on hydration layers near nanoscale silica dispersed in aqueous solutions through viscosity measurement[J].Journal of Colloid and Interface Science,2005,287:114-120.
[18] CHENG L,FENTER P,NAGY K,et al.Molecular scale density oscillations in water adjacent to a mica surface[J].Physical Review Letters,2001,87:156103-156106.
[19] 陈军.高泥化煤泥水中微细颗粒疏水聚团特性及机理研究[D].淮南:安徽理工大学,2017:119-149.
[20] CHEN J,MIN F,LIU L,et al.Experimental investigation and DFT calculation of different amine/ammonium salts adsorption on kaolinite[J].Applied Surface Science,2017,419:241-251.
[21] 彭陈亮.蒙脱石界面水化及疏水调控机理的量子力学/分子动力学研究[D].淮南:安徽理工大学,2016:63-81.
PENG Chenliang.Mechanism study on hydration of fine montmorillonite particles in coal slime water[D].Huainan:Anhui University of Science and Technology,2016:63-81.
[22] BOEK E S,COVENEY J P V,SKIPPER N T.Monte carlo molecular modeling studies of hydrated Li-,Na-,and K-smectites understanding the role of potassium as a clay swelling inhibitor[J].J Am Chem Soc,1995,117:12608-12617.
[23] CYGAN R T,LIANG J,KALINICHEV A G.Molecular models of hydroxide,oxyhydroxide,and clay phases and the development of a general force field[J].J Phys Chem B,2004,108:1255-1266.
[24] BERENDSEN H J,POSTMA J,GUNSTEREN W V,et al.Interaction models for water in relation to protein hydration[A].Intermolecular Forces[C].Berlin:Springer,1981:70-118.
[25] ARGYRIS D,HO T,COLE D R,et al.Molecular dynamics studies of interfacial water at the alumina surface[J].The Journal of Physical Chemistry C,2011,115(5):2038-2046.>